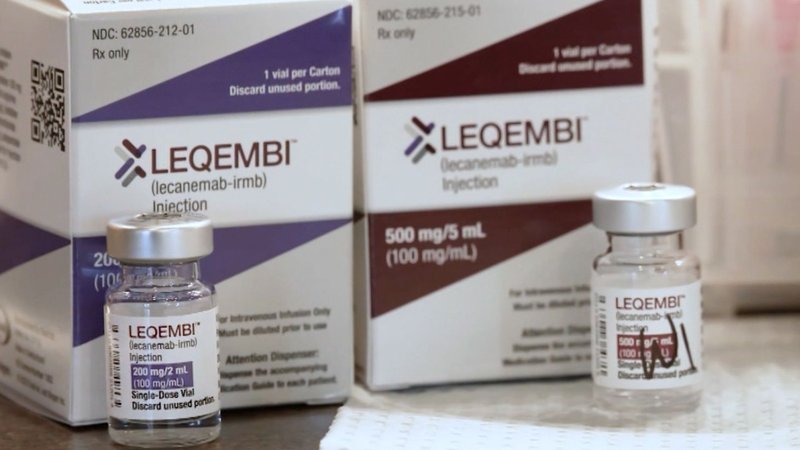
Framkvæmdastjórn Evrópusambandsins tilkynnti í dag að hún hefði formlega samþykkt Leqembi, nýtt lyf við byrjunarstigi Alzheimer, til sölu í ESB undir ströngum skilyrðum.
Samþykkið var veitt í gær á grundvelli jákvæðrar niðurstöðu Lyfjastofnunar Evrópu, sem eftir upphaflegar efasemdir, samþykkti lyfið í nóvember síðastliðinn fyrir ákveðinn hóp sjúklinga.
Leqembi, sem er þróað af bandaríska fjölþjóðafyrirtækinu Biogen og japanska fyrirtækinu Eisai, er notað til að meðhöndla fullorðna með væga minnisskerðingu og vitræn vandamál vegna Alzheimer.
Lyfið er það fyrsta sinnar tegundar sem er samþykkt í ESB og var samþykkt í samræmi við „jákvætt vísindamat Lyfjastofnunar Evrópu,“ sagði í tilkynningu framkvæmdastjórnarinnar.
Lyfjastofnun Evrópu „komst að þeirri niðurstöðu að ávinningur af notkun lyfsins væri meiri en áhættan, hjá ákveðnum hópi sjúklinga með sjúkdóminn, svo framarlega sem gripið væri til áhættuminnkunarráðstafana,“ segir í tilkynningunni. „Því eru einnig sett ströng skilyrði fyrir notkun Leqembi, sem og skýr skilyrði um áhættuminnkun.“
Lyfjastofnun Evrópu samþykkti lyfið eingöngu fyrir sjúklinga sem eru í minni áhættu fyrir mögulegum heilablæðingum.
Lecanemab hefur verið fagnað af vísindamönnum og samtökum sem sinna Alzheimer-sjúkdómnum fyrir að vera fyrsta samþykkta meðferðin sem beinist að byrjunarstigi sjúkdómsins, í stað þess að einungis meðhöndla einkenni. Lyfið virkar með því að nota mótefni sem bindast við og fjarlægja prótein sem venjulega safnast upp í heila fólks með Alzheimer.
Rannsóknir hafa sýnt að meðferðin dregur úr vitrænni hnignun um fjórðung hjá fólki á fyrstu stigum sjúkdómsins.




















Komment